Translate
sábado, 6 de julio de 2013
sábado, 1 de junio de 2013
TOMA DE MUESTRA DE SANGRE ARTERIAL
TÉCNICA EXTRACCIÓN SANGRE ARTERIAL
DEFINICION:
Es la obtención de una muestra de sangre, mediante una punción arterial, para realizar su posterior análisis en laboratorio clínico.
OBJETIVOS:
- Ayudar a la determinación de gases arteriales.
SITIOS DE PUNCIÓN
1º ARTERIA RADIAL :


Se punciona en ángulo de 45º, es más accesible y presenta menos complicaciones.
Se coloca el brazo extendido con la muñeca en hiperextensión.
Se debe realizar una presión firme durante 5 minutos, después de realizar la punción.
ARTERIA BRAQUIAL

Se punciona en ángulo de 60º, esta arteria tiene mayor tensión que la radial.
Se coloca el brazo extendido en abducción, con apoyo bajo el codo.
Se debe realizar una presión firme durante 7-10 minutos después de realizar la punción.
ARTERIA FEMORAL

Se punciona en ángulo de 90º, esta arteria tiene mayor tensión que las dos anteriores y la punción de ella conlleva mayores complicaciones.
Se coloca al paciente decúbito dorsal con la pierna en abducción.
Se debe realizar una presión firme durante 10 o más minutos, después de realizar la punción.
Elección del sitio de punción:
1.- Zona sin edemas ni hematomas.
2.- Evitar zonas excesivamente puncionadas.
3.- Zona que presente menos complicaciones para el paciente y de fácil acceso.
4.- Piel sana y limpia.
PRUEBA DE ALLEN
Antes de proceder a realizar la técnica de punción arterial radial, se debe
comprobar el flujo arterial cubital, para determinar sí esta es capaz de irrigar el brazo, en
caso de oclusión de la arteria radial, que podría deberse a una técnica de punción
defectuosa.
Para lo cual se realiza la prueba de Allen, que consiste en:
1. Se coloca la muñeca hacia arriba con la mano apoyada.
2. Se le dice al paciente que empuñe la mano.
3. Se realiza presión con dedos pulgar e índice a las arterias radial y cubital simultáneamente, por unos 30 segundos, con esta presión la mano se observa pálida.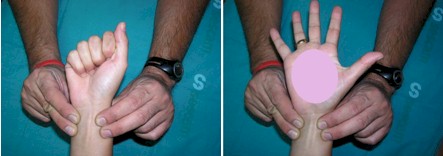
4. Se suelta la presión de la arteria cubital, haciendo que el paciente abra la mano, persistiendo la presión sobre la arteria radial.
5. Si la mano recupera su coloración rosada, indica buena capacidad de la arteria cubital para irrigar el territorio, en caso de obstrucción por hematoma de la arteria radial.
Equipo:
1 bandeja con:
set para gases arteriales
1 jeringa de 3-5 cc
1 aguja de bisel corto
Tórulas en receptáculo ad-hoc
1 frasco pequeño con antiséptico para la piel
1 ampolla de heparina para examen 9 1 sello plástico para la jeringa
1 par de guantes de procedimientos
1 receptáculo con hielo
1 receptáculo para desechos
1 pinza para desconectar agujaTécnica:

1) Lávese las manos.
2) Prepare el equipo. Heparinice la jeringa con un baño de unas gotas, aspirando desde el frasco que la contiene, cambie la aguja, por la que va a usar para puncionar al paciente.
3) Identifique si el paciente es el correcto.
4) Informe al paciente del procedimiento.
5) Elija el sitio de punción, palpando el pulso arterial.
6) Prepare el sitio de punción: realice lavado de la piel con agua y jabón, en especial sí se observa suciedad; aplique antiséptico y déjelo secar por unos 20 segundos.
7) Colóquese los guantes.
8) Realice la prueba de Allen.
9) Puncione sobre el punto en que palpa el pulso y obtenga 3 cc de muestra de sangre. Observe que la sangre fluya sin necesidad de aspirarla, se aprecia su coloración rojo brillante.
10) Retire la jeringa y comprima fuertemente por 5 minutos el sitio de punción con
algodón seco; puede solicitarle al paciente que lo haga, sí está en condiciones.
11) Separar con una pinza la aguja de la jeringa.
12) Eliminar el aire de la jeringa y sellar su punta con tapón especial.
13) Coloque en hielo, la jeringa etiquetada con el nombre del paciente.
14) Controlar el sangrado del sitio de punción, colocar gasa o algodón seco con tela.
15) Elimine el material utilizado, teniendo presente las precauciones estándar.
16) Retírese los guantes.
17) Lávese las manos.
18) Registre el procedimiento, señalando zona puncionada e intentos realizados para la unción, ya que es importante controlar posteriormente esa zona.
19) Enviar inmediatamente al laboratorio.
DEFINICION:
Es la obtención de una muestra de sangre, mediante una punción arterial, para realizar su posterior análisis en laboratorio clínico.
OBJETIVOS:
- Ayudar a la determinación de gases arteriales.
SITIOS DE PUNCIÓN
1º ARTERIA RADIAL :

Se punciona en ángulo de 45º, es más accesible y presenta menos complicaciones.
Se coloca el brazo extendido con la muñeca en hiperextensión.
Se debe realizar una presión firme durante 5 minutos, después de realizar la punción.
ARTERIA BRAQUIAL

Se punciona en ángulo de 60º, esta arteria tiene mayor tensión que la radial.
Se coloca el brazo extendido en abducción, con apoyo bajo el codo.
Se debe realizar una presión firme durante 7-10 minutos después de realizar la punción.
ARTERIA FEMORAL

Se punciona en ángulo de 90º, esta arteria tiene mayor tensión que las dos anteriores y la punción de ella conlleva mayores complicaciones.
Se coloca al paciente decúbito dorsal con la pierna en abducción.
Se debe realizar una presión firme durante 10 o más minutos, después de realizar la punción.
Elección del sitio de punción:
1.- Zona sin edemas ni hematomas.
2.- Evitar zonas excesivamente puncionadas.
3.- Zona que presente menos complicaciones para el paciente y de fácil acceso.
4.- Piel sana y limpia.
PRUEBA DE ALLEN
Antes de proceder a realizar la técnica de punción arterial radial, se debe
comprobar el flujo arterial cubital, para determinar sí esta es capaz de irrigar el brazo, en
caso de oclusión de la arteria radial, que podría deberse a una técnica de punción
defectuosa.
Para lo cual se realiza la prueba de Allen, que consiste en:
1. Se coloca la muñeca hacia arriba con la mano apoyada.
2. Se le dice al paciente que empuñe la mano.
3. Se realiza presión con dedos pulgar e índice a las arterias radial y cubital simultáneamente, por unos 30 segundos, con esta presión la mano se observa pálida.

4. Se suelta la presión de la arteria cubital, haciendo que el paciente abra la mano, persistiendo la presión sobre la arteria radial.
5. Si la mano recupera su coloración rosada, indica buena capacidad de la arteria cubital para irrigar el territorio, en caso de obstrucción por hematoma de la arteria radial.
Equipo:
1 bandeja con:
set para gases arteriales
1 jeringa de 3-5 cc
1 aguja de bisel corto
Tórulas en receptáculo ad-hoc
1 frasco pequeño con antiséptico para la piel
1 ampolla de heparina para examen 9 1 sello plástico para la jeringa
1 par de guantes de procedimientos
1 receptáculo con hielo
1 receptáculo para desechos
1 pinza para desconectar agujaTécnica:

1) Lávese las manos.
2) Prepare el equipo. Heparinice la jeringa con un baño de unas gotas, aspirando desde el frasco que la contiene, cambie la aguja, por la que va a usar para puncionar al paciente.
3) Identifique si el paciente es el correcto.
4) Informe al paciente del procedimiento.
5) Elija el sitio de punción, palpando el pulso arterial.
6) Prepare el sitio de punción: realice lavado de la piel con agua y jabón, en especial sí se observa suciedad; aplique antiséptico y déjelo secar por unos 20 segundos.
7) Colóquese los guantes.
8) Realice la prueba de Allen.
9) Puncione sobre el punto en que palpa el pulso y obtenga 3 cc de muestra de sangre. Observe que la sangre fluya sin necesidad de aspirarla, se aprecia su coloración rojo brillante.
10) Retire la jeringa y comprima fuertemente por 5 minutos el sitio de punción con
algodón seco; puede solicitarle al paciente que lo haga, sí está en condiciones.
11) Separar con una pinza la aguja de la jeringa.
12) Eliminar el aire de la jeringa y sellar su punta con tapón especial.
13) Coloque en hielo, la jeringa etiquetada con el nombre del paciente.
14) Controlar el sangrado del sitio de punción, colocar gasa o algodón seco con tela.
15) Elimine el material utilizado, teniendo presente las precauciones estándar.
16) Retírese los guantes.
17) Lávese las manos.
18) Registre el procedimiento, señalando zona puncionada e intentos realizados para la unción, ya que es importante controlar posteriormente esa zona.
19) Enviar inmediatamente al laboratorio.
TOMA DE MUESTRA DE SANGRE VENOSA
Consideraciones para la toma de muestra de sangre:
Del Personal: Las punciones vasculares deben ser realizadas por profesionales capacitados y constantemente evaluados.
Materiales: Todo material de uso venoso o intra-arterial debe ser estéril y de un solo uso. No se debe usar material desechable reesterilizado. (Medidas de Asepsia Quirúrgica)
Lavado de Manos: El profesional responsable de la punción debe lavarse las manos antes y después del procedimiento (Medidas de Asepsia Médica)
Uso de guantes: Todas las punciones venosas y arteriales deben realizarse con guantes protectores (Precauciones Estándares con sangre y fluidos corporales)


Del Personal: Las punciones vasculares deben ser realizadas por profesionales capacitados y constantemente evaluados.
Materiales: Todo material de uso venoso o intra-arterial debe ser estéril y de un solo uso. No se debe usar material desechable reesterilizado. (Medidas de Asepsia Quirúrgica)
Lavado de Manos: El profesional responsable de la punción debe lavarse las manos antes y después del procedimiento (Medidas de Asepsia Médica)
Uso de guantes: Todas las punciones venosas y arteriales deben realizarse con guantes protectores (Precauciones Estándares con sangre y fluidos corporales)

- Elección del sitio de punción: La piel del sitio de punción elegido, debe estar indemne y limpia. Se deben utilizar preferentemente, venas del pliegue del codo, medianas basílicas o cefálicas.
- Preparación del sitio de punción: Piel limpia, en caso contrario se debe avar con agua y jabón antes de aplicar el antiséptico.
- La pincelación del sitio de punción debe ser con alcohol de 70º, una vez aplicado, esperar que tome contacto con la piel al menos por 30 segundos, antes de puncionar.
- Desecho de R.P.B.I. : La eliminación de la jeringa y aguja debe ser en receptáculo especialmente designado (tarro o botella plástica desechable) sin doblar, lavar, quebrar o recapsular la aguja.
INDICACIONES GENERALES TOMA MUESTRAS EXÁMENES DE SANGRE
- Explicar al paciente acerca de la indicación médica del examen, dando instrucciones respecto a la preparación, necesidad de ayuno, tipo de régimen y objetivos del examen.
- Constatar que el paciente está en las condiciones requeridas para el examen (ayunas u otra) En general los exámenes de sangre se toman en ayunas, pues la ingesta de alimentos puede hacer variar los resultados de algunos exámenes.
- Controlar que el paciente ingiera desayuno después de la toma de la muestra.
- Una vez tomadas las muestras deben ser enviadas a la brevedad al laboratorio, ya que éstas continúan con su metabolismo, al permanecer a temperatura ambiente, produciéndose alteración de los valores reales del paciente.
- No deben utilizarse frascos que merezcan dudas, sin tapas, sucios o con cantidad insuficiente de anticoagulante.
TOMA DE MUESTRA SANGRE VENOSA
DEFINICIÓN:
Es la obtención de una muestra de sangre, mediante una punción venosa periférica o central, para realizar el posterior análisis en el laboratorio clínico.
OBJETIVOS:
- Ayudar al diagnóstico médico (reacción de aglutinación: en fiebre tifoidea)
- Indicar tratamiento específico (vitamina B12: en anemia perniciosa)
- Controlar la evolución de una enfermedad (bilirrubinemia: en hepatitis
2.1.1. TÉCNICA EXTRACCIÓN SANGRE VENOSA
EQUIPO:
Bandeja con:
1 jeringa desechable 5-10-20 cc según la cantidad de sangre requerida
1 aguja Nº 21 de repuesto
1 receptáculo con tórundas de algodón
Receptáculo para residuos punzocortantes
1 pequeño frasco con solución antiséptica (alcohol al 70%)
1 torniquete
tela adhesiva
1 almohadilla
1 par de guantes de procedimientos
tubos de exámenes
ordenes médicas de exámenes
TECNICA:


1) Lávese las manos y prepare el equipo.
2) Lleve el equipo a la unidad del paciente.
3) Identifique al paciente verbalmente o revisando la ficha clínica.
4) Explíquele el procedimiento a realizar.
5) Lávese las manos.
6) Acomode al paciente con la zona a puncionar sobre la almohadilla.
7) Revise la piel y las venas del paciente.
8) Seleccione el sitio que le merezca mayor seguridad de éxito en la técnica y de menor riesgo para el paciente.
9) Si es necesario, lave la zona con agua y jabón.
10) Al seleccionar el sitio de punción prefiera las venas del pliegue del codo por tener
mejor calibre lo que permite un mejor acceso. Coloque la ligadura para facilitar esta
elección, tenga la precaución de soltarla, una vez elegida la vena.
11) Colóquese los guantes, arme la jeringa.
12) Coloque la ligadura 4 traveses de dedos sobre el lugar a puncionar.
13) Desinfecte un área de 5 cm de la piel del paciente, con alcohol al 70%.
14) Deje una tórula seca entre los dedos anular y meñique de su mano dominante.
15) Fije la vena traccionando la piel que la circunda y solicite al paciente que empuñe la mano suavemente.
16) Inserte la aguja con el bisel hacia arriba, puncione la vena, dirigiendo la aguja en la misma dirección en que ésta se encuentra, (puncionado primero la piel, trate de no puncionar directamente sobre la vena, puesto que la puede atravesar e impedirle tomar la muestra) y observe el reflujo de sangre.
17) Obtenga la cantidad de sangre requerida.
18) Suelte la ligadura, pídale al paciente que suelte la mano empuñada.
19) Retire la jeringa, deje la tórula seca en el sitio de punción, pidiéndole al paciente, dentro de lo posible, que la afirme sin flectar el brazo.
20) Llene con la cantidad necesaria los frascos de examen, siempre llene primero los frascos que tienen anticoagulantes, girándolos según corresponda.
21) Coloque tela adhesiva con un pequeño trozo de algodón seco o parche curita en el sitio de punción.
22) Acomode al paciente.
23) Lleve el equipo y deseche material punzante en receptáculo ad-hoc y el resto en basurero.
24) Retírese los guantes, lávese las manos

lunes, 29 de abril de 2013
TOMA DE MUESTRAS SANGUÍNEAS.( sangre capilar)
LA SANGRE: CARACTERÍSTICAS Y FUNCIONES.
El cuerpo humano adulto tiene entre 4,5 y 6 litros de sangre. El 55% es plasma, que es la parte líquida, compuesta por agua, sales minerales y proteínas. El 45% restante se compone de glóbulos rojos, glóbulos blancos y plaquetas. La sangre también transporta gases, hormonas, vitaminas, glucosa, etc.
La sangre tiene la función de hacer llegar el oxígeno y el alimento a todas las células del cuerpo, y retirar el anhídrido de carbono y las sustancias de desecho.
Una gran parte del plasma es agua, medio que facilita la circulación de muchos factores indispensables que forman la sangre. Un milímetro cúbico de sangre humana contiene unos cinco millones de corpúsculos o glóbulos rojos, llamados eritrocitos o hematíes; entre 5.000 y 10.000 corpúsculos o glóbulos blancos que reciben el nombre de leucocitos, y entre 200.000 y 300.000 plaquetas, denominadas trombocitos. La sangre también transporta muchas sales y sustancias orgánicas disueltas.
Composición de la sangre
La sangre está formada por un líquido amarillento denominado plasma, en el que se encuentran en suspensión millones de células que suponen cerca del 45% del volumen de sangre total. Tiene un olor característico y una densidad relativa que oscila entre 1,056 y 1,066. En el adulto sano el volumen de la sangre es una onceava parte del peso corporal, de 4,5 a 6 litros.
Por la circulación sanguínea viajan tres tipos de células:
1.- Los glóbulos rojos o hematíes. También llamados eritrocitos. Constituyen aproximadamente el 40% del volumen sanguíneo. Se producen en la médula ósea. Son células en forma de disco bicóncavo que no tienen núcleo. En la sangre hay normalmente entre 4 y 5,5 millones por milímetro cúbico (mm3). Viven unos 120 días. Su tamaño es de unas 8 micras (8 milésimas de milímetro). Su función es transportar el oxígeno desde los pulmones hasta las células de todos los tejidos corporales. Para ello utilizan una proteína llamada hemoglobina, que contiene hierro y es capaz de trasportar moléculas de oxígeno. La hemoglobina es lo que da el típico color rojo a los hematíes. Cuando por alguna enfermedad hay falta de hematíes en la sangre se padece de anemia. El índice hematocrito es un indicador sobre el porcentaje de glóbulos rojos que hay en la sangre por unidad de volumen; lo normal esta entre 42% y 50% en hombres y entre el 38% y 47% en mujeres. Las características de la membrana de los hematíes definen los grupos sanguíneos.

2.- Glóbulos blancos o leucocitos. Son células defensivas que forman parte del sistema inmunológico. Tienen la función de combatir los microorganismos y cuerpos extraños. Se producen en la médula ósea. En la sangre hay entre 4.000 y 10.000 leucocitos por milímetro cúbico. Los glóbulos blancos están dispersos por todo el cuerpo, y muchos de ellos se adhieren a las paredes de los vasos sanguíneos o los traspasan para ir a otros tejidos o allí donde sean necesarios.
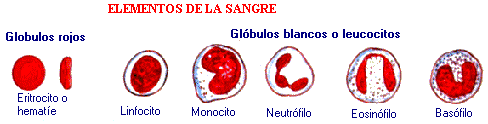
Hay varios tipos de leucocitos, que se clasifican en:
- Granulocitos: Son células defensivas que tienen un núcleo polimorfo con numerosos gránulos en su citoplasma. Se clasifican a su vez en 1) neutrófilos, 2) basófilos y 3) eosinófilos. Los neutrófilos son los encargados de fagocitar o "comerse" sustancias extrañas, como las bacterias y los agentes externos que entran en el cuerpo; son los leucocitos más numerosos y su cantidad aumenta cuando hay una infección. Los basófilos segregan sustancias anticoagulantes y participan en el control de la inflamación. Los eosinófilos son células fagocitarias que eliminan los complejos antígeno-anticuerpo y que por su capacidad citotóxica tienen una función de defensa ante los microorganismos no fagocitables, como los parásitos.

- Linfocitos: Son los leucocitos de menor tamaño y las células del sistema inmunológico especializadas en regular la inmunidad adquirida. Se localizan en los ganglios linfáticos. Los linfocitos son los encargados de la producción de anticuerpos y de la destrucción de células defectuosas. Hay dos tipos: 1) los linfocitos T tienen una función inmunológica celular; 2) los linfocitos B se encargan de fabricar los anticuerpos.
- Monocitos: Son las células sanguíneas de mayor tamaño. Después de viajar por la sangre llegan al tejido conectivo, donde se convierten en macrófagos. Su función consiste en fagocitar microorganismos y restos celulares, rodeándolos con sus pseudópodos.
3.- Las plaquetas o trombocitos. Son partículas (no propiamente células) que participan en la coagulación de la sangre. Son necesarias para taponar rápidamente las heridas e impedir hemorragias. Se fabrican en la médula ósea. Tienen un tamaño de 3 o 4 micras, son de forma oval y no tienen núcleo. Suele haber entre 140.000 y 450.000 plaquetas por milímetro cúbico. Hay una enfermedad hereditaria llamada hemofilia que consiste en un déficit en la coagulación de la sangre.
Tipos de Obtención de Muestras de Sangre.
La toma de una muestra es el acto en el que se recoge, bien por el propio paciente, bien por un profesional sanitario: tejido, secreción, excremento... de una persona, para su posterior estudio en el Laboratorio.Para efectuar análisis clínicos, las muestras de sangre pueden ser:
❖ Sangre capilar o periférica.
❖ Sangre arterial.
❖ Sangre venosa.
Sangre capilar o periférica.· Generalidades:
La sangre de flujo es llamada comúnmente capilar o periférica y es la que fluye después de aplicar una punción superficial cutánea. Cuando no es posible obtener una muestra de sangre venosa o no se desea puncionar la vena, algunas pruebas pueden realizarse con sangre capilar o periférica obtenida del lóbulo de la oreja o de la yema del dedo. En los niños recién nacidos por punción del talón.
No es aconsejable utilizar sangre capilar para la cuenta de plaquetas por la rapidez con la que las mismas se adhieren y agregan en el lugar de punción y se obtienen datos falsos de cuentas bajas de plaquetas; en cambio para preparar extendidos en laminillas es mejor hacerlo con sangre capilar, ya que el anticoagulante puede provocar alteraciones en los leucocitos.
Lugares idóneos de extracción capilar:
Las zonas más comunes de extracción son:
- Pulpejo del dedo de la mano: para determinaciones rápidas.
- Lóbulo de la oreja: sobre el borde inferior del pabellón auricular.
- Talón del pie: en recién nacidos o en adultos con imposibilidad de obtención de la muestra en otras zonas.
- Pulpejo del dedo del pie.
(Ver Imagen 1)
· Analítica en sangre capilar:
La muestra de sangre capilar se obtiene por prescripción facultativa y se emplea para las siguientes determinaciones entre otras:
- Grupos sanguíneos.
- Glucemia.
- Pruebas de coagulación.
- Recuento celular.
- Morfología celular.
- Hematocrito.
- Fórmula leucocitaria.
SITIOS DE PUNCIÓN DONDE TOMAR SANGRE CAPILAR


· Material:
Son necesarios los siguientes utensilios para la extracción:- Lancetas estériles.
- Algodón
- Alcohol del 70% - 90%
- Tiritas
- Guantes: desechables y estériles
- Plastelina.
- Material de recogida según determinación
- Rotulador para identificar la muestra.
obtener un frotis de sangre, para ello seguir los siguientes pasos:
1. Recoger una pequeña gota de sangre y depositarla a 1cm del extremo de un porta
objetos totalmente limpio.
2. Extender mediante otro portaobjetos de la manera siguiente: poner el
portaobjetos en contacto con la gota, que en principio se alargará en una línea en
la zona de contacto de los dos portas. Hacer deslizar el portaobjetos esmerilado
sobre el porta soporte en dirección opuesta a la de la gota de sangre; ésta, por
tensión superficial, se extiende formando una lámina muy delgada. De esta
manera, la gota es atraída por el portaobjetos esmerilado y no empujada. (ver
figura).
3. Dejar secar al aire.
FROTIS SANGUINEO TEÑIDO.
Observación:
Reconocerás cada uno de los leucocitos por su coloración y tamaño. Deberás hacer un
recuento de diferentes campos microscópicos, utilizando el objetivo de 40X o el de
100X, contabilizando el número
ERITROCITOS (Glóbulos rojos) :
Los Glóbulos rojos son las células que contienen en su interior la hemoglobina. Son los principales
portadores de oxígeno a las células y tejidos del cuerpo. Tiene forma bicóncava para adaptarse a una mayor superficie de intercambio de oxígeno por dióxido de carbono en los tejidos. En los mamíferos, no poseen núcleo.
PLAQUETAS:
Las plaquetas son células de la sangre producidas por los megacariocitos en la médula ósea mediante el proceso de fragmentación citoplasmática, circulan por la sangre y tienen un papel muy importante en la coagulación. Son los componentes celulares mas pequeños de la sangre.
LEUCOCITOS (Glóbulos Blancos):
.
NEUTRÓFILOS:
Células de 7-9 um con granulación menos evidente que la de los eosinófilos, presentan núcleos polilobulados, contienen proteínas de propiedades bactericidas (fagocitan y destruyen
células bacterianas). También denominados polimorfonucleares, de núcleo arriñonado,
formando cuatro o cinco lóbulos; reciben por ello, el nombre de polimorfonucleares o, simplemente
"polis".
EOSINÓFILOS:
Su nivel aumenta en las infestaciones por parásitos, en
reacciones alérgicas, en el asma y en alguna patología del
miocardio. Tienen el Núcleo bilobulado y granulación de
tamaño medio, con fuerte apetencia por la eosina. Núcleo
bilobulado y granulación de tamaño medio y fuerte apetencia
por la eosina
BASÓFILOS:
Los gránulos de los basófilos son gruesos pero escasos. Son
células de unas 10 micras de diámetro y su núcleo tiene una
forma que recuerda a un 5. Se originan en el mismo lugar que
el resto de los granulocitos, y son los menos numerosos, ya
que constituyen sólo el 0,5% del total. Tienen una activa
participación en la respuesta alérgica a través de la liberación
de histamina y otras sustancias químicas.
LINFOCITOS:
Los linfocitos son las células responsables de
las respuestas inmunitarias. Se dividen en dos
grandes grupos, linfocitos B y linfocitos T,
según que estos progenitores linfoides
maduren en la médula ósea (B) o en el timo
(T), respectivamente. No existe diferencia
morfológica , observable a Microscopio óptico, entre ambos tipos de linfocitos. Son los glóbulos blancos más pequeños, con
núcleo que ocupa casi la totalidad del volumen celular y no presentan granulación
específica.
MONOCITOS:
Al igual que otros glóbulos blancos, los monocitos se
originan en la médula ósea y luego entran en el flujo
sanguíneo. En unas horas, emigran a los tejidos donde se
convierten en macrófagos, y constituyen las células
defensivas (fagocitos) . Son de mayor tamaño que los
linfocitos con núcleo redondo o arriñonado.
continuaremos con la toma de muestra venosa pronto...
viernes, 19 de abril de 2013
TOMA DE MUESTRA DE EXUDADO FARÍNGEO..
A.-EXUDADO FARINGEO
La faringoamigdalitis aguda es proceso inflamatorio de la mucosa y estructuras subyacentes de la faringe. Es más frecuente en niños con edades comprendida entre los 3 y 15 años y durante los meses de invierno. Clínicamente se caracteriza por la aparición de dolor agudo de garganta (odinofagia), frecuentemente acompañado de fiebre, adenitis cervical y presencia o no de congestión y secreción nasal. La causa mas frecuente es una infección viral, pero hay casos ocasionados por bacterias, en especial por el estreptococo beta hemolítico del grupo A, que requerirán tratamiento antibiotico.
La faringitis aguda incluye dos formas de presentación: A) Amigdalitis o tonsilitis: Término que hace referencia a la inflamación de las amígdalas. B) Faringitis: Término que hace referencia a la inflamación de la orofaringe (amígdalas, paladar blando y úvula).
El diagnóstico de presunción se establece clínicamente, y el definitivo se realiza mediante cultivo del exudado faríngeo, aunque una alternativa son las pruebas rápidas de detección del antígeno del estreptococo del grupo A en muestras faríngeas.
El objetivo del tratamiento es prevenir la fiebre reumática, reducir la gravedad y duración de los síntomas y prevenir la transmisión de una persona a otra.
Precauciones e indicaciones para un exudado faríngeo.
Dentro de las consideraciones generales para el exudado faríngeo debemos tomar en cuenta: El diagnóstico de laboratorio correcto y oportuno depende del cuidado con que se realice la toma, manejo y envío de muestras siguiendo al detalle las instrucciones al respecto. La interpretación del resultado del laboratorio debe estar apoyada por un buen diagnóstico clínico y los antecedentes epidemiológicos del caso. La muestra para aislamiento de agentes infecciosos debe ser tomada ANTES de instaurar la terapia con antimicrobianos. La muestra debe identificarse utilizando una cinta de tela adhesiva, escrita con LAPIZ, donde se incluya todos los datos relevantes del caso: nombre completo o clave, diagnóstico presuntivo, fecha de toma y tipo de muestra indicando si es 1a, 2a o 3a. La muestra debe acompañarse siempre de un resumen clínico del caso y sus antecedentes, así como de cualquier dato epidemiológico relevante.
Etapas en la realización de un exudado faríngeo.
a.-Toma de muestra Sentar al paciente y colocar su cabeza hacia atrás iluminar bien la cavidad orofaríngea y con un abatelenguas bajar la lengua para facilitar el acceso a la parte posterior de la faringe.

Con un hisopo de dacrón o de rayón con mango de plástico, hacer un raspado firme, haciendo girar el hisopo, en las áreas dañadas que deben verse hiperémicas, purulentas o necróticas y también en las membranas formadas sobre las lesiones o de las manchas de Koplic. Hay que evitar tocar la lengua, la úvula o los carrillos. Introducir el hisopo con la muestra en un tubo con tapón de rosca que contenga el medio de transporte adecuado a la etiología que se sospeche.
Para diagnóstico de enfermedades exantemáticas tomar la muestra durante los 5 días inmediatos a la aparición del exantema. Medio de transporte para agentes virales: 2.5 (3.0) ml de medio de transporte viral estéril o de solución salina isotónica estéril Medio de transporte para agentes bacterianos: Medio de (Amies o de Stuart).

Para diagnóstico de virus respiratorios tomar la muestra durante las 96 horas inmediatos a la aparición del los síntomas. Condiciones para su conservación Enviar lasmuestras lo más pronto posible. En caso de sospecha de etiología viral, mantener las muestras a 4°C hasta su entrega en el laboratorio. Las muestras que se han recolectado en solución salina isotónica estéril se deberán entregar al laboratorio en un lapso no mayor a 24 horas. En caso de sospecha de etiología bacteriana, mantener las muestras a temperatura ambiente
-Disposición final de Residuos Peligrosos Biológico Infecciosos que se generan durante el exudado faríngeo- Para la disposición de residuos se deberá seguir lo establecido en la NOM-087-SEMARNAT-SSA1-2002 publicada en el diario oficial publicado el día lunes 17 de febrero de 2002.
PROCESAMIENTO DE LA MUESTRA:
TRANSPORTE DE LA MUESTRA PARA SU CULTIVO.
CULTIVO DE EXUDADO FARINGEO

COLONIAS EN AGAR SANGRE.

REACCIONES HEMOLITICAS BACTERIANAS (AGAR SANGRE)


Prueba de Catalasa
Técnica:
- En un portaobjetos hacer una suspensión con un agota de peróxido de hidrogeno 30%.
- Observar la formación de burbujas.
- Esta prueba es: Catalasa positiva para Stafilococos
Catalasa negativa para Estreptococos.

PRACTICA DE LABORATORIO: TOMA DE MUESTRA Y CULTIVO DE EXUDADO FARÍNGEO.
Introducción: El cultivo faríngeo es una prueba de laboratorio común para la identificación y el aislamiento de microorganismos que puedan causar una infección en la garganta. Esta se realiza para identificar causas de los malestares de garganta.
Materiales:
Depresor de lengua
Torunda estéril
Placas de agar-sangre
Asa de siembra
Cinta adhesiva
Mechero de bunsen
Guantes.
El estudio microbiológico del frotis faríngeo es una prueba muy solicitada, sobre todo entre la población infantil y a la que hay que dar su verdadero valor. En principio el frotis faríngeo servirá sólo para los propósitos expuestos en los apartados siguientes:
Para diagnosticar: angina estreptocócica (Streptococcus beta-hemolítico del grupo A), difteria, muguet, angina de Vincent, infección por Haemophilus.
Para establecer focos de infección en enfermedades como: fiebre reumática (Streptococcus betahemolítico del grupo A), glomerulonefritis hemorrágica aguda (Streptococcus beta-hemolítico del grupo A), escarlatina (Streptococcus beta-hemolítico del grupo A), endocarditis (Streptococcus viridans ), tos ferina (Bordetella ).
Para detectar portadores de: Staphylococcus aureus, Streptococcus beta-hemolítico del grupo A, Neisseria meningitidis, Corynebacterium diphteriae.
Hay una tendencia general a no investigar el neumococo (Streptococcus pneumoniae ) en garganta, pues está presente en muchas personas que no presentan ninguna sintomatología (30 por 100 de portadores sanos).
OBTENCION DE LA MUESTRA Y METODOLOGIA
Para diagnosticar: angina estreptocócica (Streptococcus beta-hemolítico del grupo A), difteria, muguet, angina de Vincent, infección por Haemophilus.
Para establecer focos de infección en enfermedades como: fiebre reumática (Streptococcus betahemolítico del grupo A), glomerulonefritis hemorrágica aguda (Streptococcus beta-hemolítico del grupo A), escarlatina (Streptococcus beta-hemolítico del grupo A), endocarditis (Streptococcus viridans ), tos ferina (Bordetella ).
Para detectar portadores de: Staphylococcus aureus, Streptococcus beta-hemolítico del grupo A, Neisseria meningitidis, Corynebacterium diphteriae.
Hay una tendencia general a no investigar el neumococo (Streptococcus pneumoniae ) en garganta, pues está presente en muchas personas que no presentan ninguna sintomatología (30 por 100 de portadores sanos).
OBTENCION DE LA MUESTRA Y METODOLOGIA
INDICACIONES PREVIAS
- Venir al laboratorio en completo ayuno preferiblemente, o dos horas después de haber ingerido alimentos o bebidas, en caso de iniciar algún tipo de tratamiento con antibióticos.
- No usar enjuague bucal el día de la toma de muestra.
- No fumar antes ni durante la realización de exámenes de Laboratorio.
- No ingerir bebidas alcohólicas tres días antes de la realización de exámenes de Laboratorio.
- Si esta tomando algún medicamento, debe informar en la toma de la muestra el nombre del medicamento y la dosis que esta tomando.
Para la toma de muestras de faringe se dispondrá de dos hisopos, Se utilizará un depresor lingual y se evitara rozar cualquier parte de la lengua.Uno de ellos se utilizará para hacer tinciones, y el otro para hacer cultivos.
Sentar al paciente y colocar su cabeza hacia atrás iluminar bien la cavidad orofaríngea y con un abatelenguas, bajar la lengua para facilitar el acceso a la parte posterior de la faringe. Con un hisopo de dacrón o de rayón con mango de plástico, hacer un raspado firme, haciendo girar el hisopo, en las áreas dañadas que deben verse hiperémicas, purulentas o necróticas y también en las membranas formadas sobre las lesiones o de las manchas de Koplic. Hay que evitar tocar la lengua, la úvula o los carrillos. Introducir el hisopo con la muestra en un tubo con tapón de rosca que contenga el medio de transporte adecuado a la etiología que se sospeche.

Medio de transporte para agentes virales: 2.5 (3.0) ml de medio de transporte viral estéril o de solución salina isotónica estéril
Medio de transporte para agentes bacterianos: Medio de (Amies o de Stuart)Enviar las muestras lo más pronto posible. En caso de sospecha de etiología viral, mantener las muestras a 4°C hasta su entrega en el laboratorio. Las muestras que se han recolectado en solución salina isotónica estéril se deberán entregar al laboratorio en un lapso no mayor a 24 horas. En caso de sospecha de etiología bacteriana, mantener las muestras a temperatura ambiente.
CULTIVO DE LA MUESTRA.

__________________________________________________________________________
En de la izquierda es positivo para Staphylococcus y en la derecha postivo para un cultivo de Streptococcus

REACCIONES HEMOLITICAS.


EN AGAR SAL Y MANITOL.
HISOPADO FARINGEO (Staphylococcus aureus)
Suscribirse a:
Entradas (Atom)













